M. DMD 치료제
유전성 희귀 소아질환 듀센형 근이영양증 치료제 개발
-
 효력시험
효력시험
-
 독성실험
독성실험
-
 임상진행
임상진행
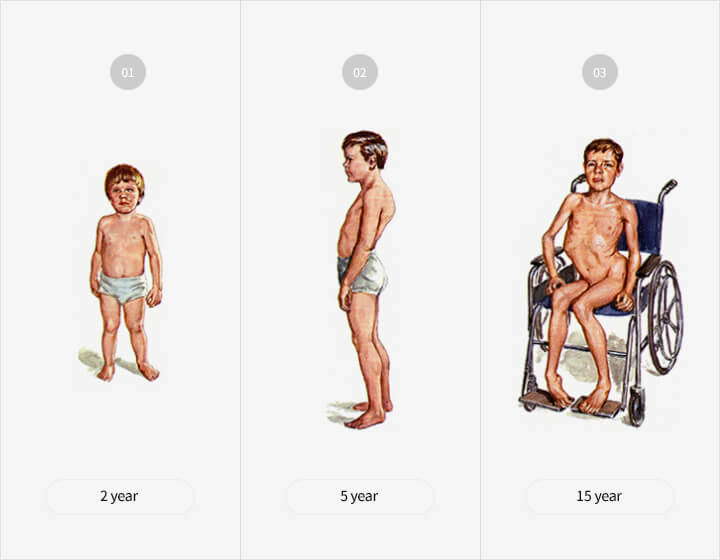
질환특징
- 근디스트로피 환자 중 80~85%, 듀센형 근이영양증 환자
- 출생 남아 3,500명 당 1명 비율
- 주로 3~4세경부터 자세 변형 등 증상 시작, 점진적 근육 소멸
→ 호흡근이 약화되는 20대 전반에 대부분 사망 - 현재 치료제 없어 완치 불가, 신약개발 필요성 대두
- 근육 생성저해물질인 마이오스타틴을 타겟 항원으로 선정

출처 : https://auroshealthcare.wordpress.com/
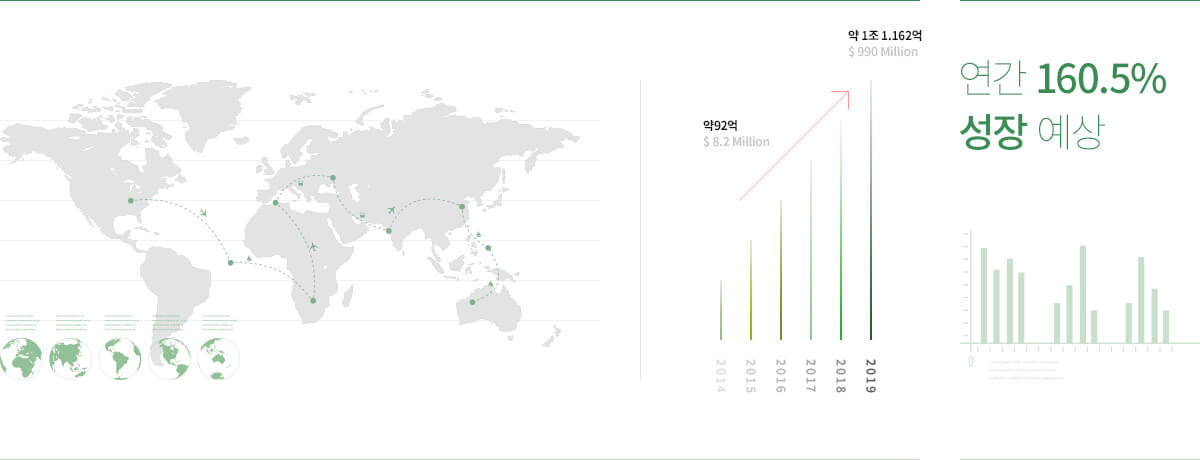
세계시장 가치
현황
2018.02 미국 FDA로부터 희귀의약품 지정(ODD) 승인 완료 → PRV 획득 가능성 증대
2019.01 한국 MFDS로부터 희귀의약품 지정(ODD) 승인
Orphan Drug Designation 혜택
- 임상시험 기간 연구보조금 지원
- 임상시험 비용 세금 공제
- 신약허가신청 심사비용 면제
- 임상2상 이후 조건부 판매 가능
- 시판허가 후 7년간 마케팅 독점권 부여
- [삼성서울병원] 2012.01 공동연구개발 협약
- 보건복지부 첨단의료기술개발 과제 선정 및 수행 (2015~2018년)
전략
- 임상2상 완료 · 미국 FDA로부터 시판 허가 취득
- 기술파트너 추가 확보 → 현지 파트너와 합작회사 또는 라이센싱 아웃 진행
- PRV 취득
- 미국 FDA 지정 희귀질환 혁신신약 치료제 개발 시 바우처 수령 : 개발사의 타 의약품 허가기간 6개월로 단축
→ 수익 기간 연장 및 매출 확대 가능 - 직접 사용 또는 판매 가능 : 현재 PRV 판매 가치 평균 2,100억 원 이상으로 형성

· DMD 질환 관련, PRV 취득 현황
| Year | Company | Drug | Comments |
|---|---|---|---|
| 2017 |  |
Emflaza(deflazacort) | FDA Press release |
| 2016 |  |
Exondys51(eteplirsen) | |
| Sarepta has sold PRV to Gilead for $125m |  |
||
출처 : http://priorityreviewvoucher.org